IFTS 10 – QUIMICA INORGANICA Prof R. Casas
– Serie 2 -
Uniones Químicas
Las propiedades de las sustancias están determinadas en parte por los enlaces químicos que mantienen unidos a los átomos. Cuando los átomos interactúan para formar un enlace químico, solo entra en contacto sus regiones más externas, es decir los electrones que están en su capa exterior.
Se define Unión Química como la fuerza de unión que existe entre dos átomos, cualquiera que sea su naturaleza, debido a la transferencia total o parcial de electrones para adquirir ambos la configuración electrónica estable correspondiente a los gases inertes. Esta es una fuerza muy grande, responsable de la relativa estabilidad de los compuestos.
¿Porqué se unen los átomos?: esto se debe porque siguen una tendencia a llegar al estado de energía mínima (más estable). En otras palabras, cuando dos átomos se unen para formar un enlace estable, se libera una cierta cantidad de Energía (energía de enlace).
La materia que nos rodea está constituida por sustancias con distinto aspecto y propiedades. El conocimiento de tales propiedades puede aportar alguna información acerca de las fuerzas que hacen unirse a las partículas que forman una sustancia. Así, por ejemplo, los puntos de fusión y ebullición de las diversas sustancias son indicativos de la mayor o menor fuerza de enlace entre las partículas (átomos, iones o moléculas) que constituyen el sólido o líquido (si son altos cabe pensar en enlaces fuertes y si son bajos en enlaces débiles). Si una sustancia, en determinadas condiciones, conduce la corriente eléctrica, podría pensarse en la existencia de partículas cargadas, ya que la corriente eléctrica supone precisamente un desplazamiento de cargas. Otras propiedades pueden ser la solubilidad, la facilidad de deformación, la dureza, la facilidad para romperse (fragilidad), etc.
El agua, por ejemplo, es una sustancia que a la presión atmosférica funde a 0ºC, hierve a 100 ºC y apenas conduce la corriente eléctrica, mientras que el hierro funde a 1535 ºC, hierve a 3233 ºC y sí conduce la corriente eléctrica; el diamante es muy duro, mientras que el sodio se puede cortar con un cuchillo, etc.
Otro concepto muy importante para establecer características de las uniones es la electronegatividad, que se define como "la capacidad relativa que tiene un átomo para atraer electrones de una unión química".
Linus Pauling diagramó una tabla cuyos valores, basados en datos termoquímicos, han sido determinados en una escala arbitraria, denominada escala de Pauling, cuyo valor máximo es 4 que es el valor asignado al flúor, el elemento más electronegativo. El elemento menos electronegativo, el cesio, tiene una electronegatividad de 0,7.
Teniendo en cuenta el concepto de electronegatividad, podemos entender la existencia de diferentes tipos de uniones químicas, de acuerdo a la fuerza con que los átomos atraen los electrones del enlace:
- Cuando los valores de e.n. de los átomos que intervienen en la unión sean muy diferentes.
- Cuando ambos átomos posean electronegatividad baja y similar
- Cuando los átomos posean electronegatividad alta y similar.
En general, se puede observar que valores de Electronegatividad de 2,5 o mayores son de los no metales y valores de 1,3 o menores son valores de metales alcalinos y alcalinotérreos. Entre ambos extremos se encuentran los valores de los metales de transición.
Cuando los elementos que se unen presentan electronegatividades muy diferentes, la unión es típicamente iónica y cuando las electronegatividades son muy próximas, la unión es covalente.
Tipos de uniones
|
Ejemplos
|
Diferencia entre electro(-)
|
Iónicas
|
Na+ Cl-
|
Cl (3.0) – Na (0,9) = 2,1
|
Covalente polar
|
H2O
|
O (3,5) – H (2,1) = 1,4
|
Covalente no polar
|
CH4
|
C (2,5) – H (2,1) = 0,4
|
https://youtu.be/9Oljha_Syv8
Con la información obtenida en la determinación de la estructura electrónica de los elementos que vimos en la serie 1, podemos ver la estructura molecular de los compuestos.
Un examen de los resultados de la estructura electrónica de los gases inertes, nos muestra que:
He 2
Ne 2, 8
Argón 2, 8, 8
Kryptón 2, 8, 18, 8
Xenón 2, 8, 18, 18, 8
Radón 2, 8, 18, 32, 18, 8
En cada uno de estos átomos, con excepción del Helio, la capa más externa contiene 8 electrones, independientemente de que las capas internas hayan sido completadas o no.
Como los gases inertes son extremadamente inactivos, se puede establecer que un grupo externo de 8 electrones es una distribución excepcionalmente estable.
Por lo tanto uno de los postulados de la teoría electrónica de valencia establece que, en general, la combinación de los átomos se realiza de manera tal que conduce mientras sea posible, a la formación de octetos electrónicos completos. Y esto se conoce como Regla del Octeto.
Entonces, en la formación del enlace, los átomos pierden, ganan o comparten sus electrones de valencia, con el fin de alcanzar la configuración electrónica y estabilidad del gas noble más próximo a ellos. Es decir ocho electrones en su capa de valencia, con excepción del helio que solo tiene dos, esto se conoce como Regla del Octeto.
Ejemplos:
Formación del ión positivo: Na+.
Nao...........................................................................................> Na+ + 1 e-catión
Átomo de sodio ión sodio
( 1s², 2s² 2p6, 3s1) (1s², 2s² 2p6) [Estructura del gas noble Ne]
Formación del ion negativo: Cl¯.
Átomo de cloro ión cloruro
(1s², 2s² 2p6, 3s2 3p5) (1s², 2s² 2p6, 3s2 3p6) [Estructura del gas noble Ar]
El hecho de que existan tantas propiedades y que éstas puedan tomar valores muy distintos dependiendo de la sustancia de que se trate, hace que resulte difícil clasificar en unos pocos grupos a todas las sustancias y cualquier regla que se establezca para ello dejará fuera a sustancias con propiedades intermedias o atípicas. No obstante, a pesar de estos inconvenientes, ha sido posible clasificar a la mayor parte de las sustancias en tres grandes grupos: En primer lugar nos encontramos con sustancias como el
cloruro de sodio, sulfato de cobre, sulfato de calcio, fluoruro de calcio... que suelen ser compuestos sólidos de aspecto cristalino, frágiles y con elevados puntos de fusión y ebullición. Son, en general, más o menos solubles en disolventes del tipo del agua y no lo son en disolventes tipo benceno. No son conductores de la corriente en estado sólido, pero sí lo son sus disoluciones acuosas y también ellos mismos cuando se funden. La existencia de este grupo de sustancias, está ligada a una forma de enlace que, por razones que luego veremos, se denomina enlace iónico, designando consecuentemente dichas sustancias como compuestos iónicos.
Enlace iónico
Este enlace ocurre entre átomos de elementos cuyas electronegatividades son muy diferentes y hay transferencia completa de electrones desde un átomo al otro. Se estipula que cuando las diferencias de electronegatividades supera el valor de 1,5 en la escala de Pauli, la unión es predominantemente iónica.
Un ejemplo de unión iónica es el LiF
Li (1s22s1 )Li+ (1s2) + e- tendrá la CE del He
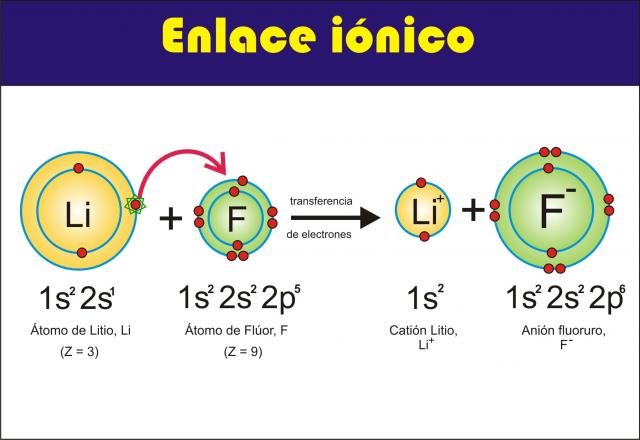
Debido a su mayor electronegatividad el F atraerá los electrones de la unión hacia su núcleo, esto producirá la transferencia del electrón del Li hacia el F. Resulta la formación de una partícula con carga (+) y otra con carga (-) con la CE estable. Este tipo de uniones se llaman IONICAS.
Las fuerzas de atracción se extienden en todas direcciones el ion Li+ se rodea de cierto número de F- y a la inversa. Por ello que el LiF no existe como molécula, sino que constituye una red tridimencional, en la cual cada Li+ está rodeado por 6 F- y al mismo tiempo cada F- rodeado por 6 Li+. Este ordenamiento regular, formado por repetición de una estructura de geometría cúbica llamada celda unitaria (ejemplo del NaCl)
Características de los compuestos iónicos
El mineralogista francés René Just Haüy (1743-1822), fue el primero que afirmó que las formas externas regulares de los cristales iónicos sugieren la existencia de una estructura microscópica ordenada, al suponer que cada cristal está formado por adiciones sucesivas de lo que hoy se conoce como células fundamentales para dar lugar a unas figuras geométricas simples de ángulos constantes y de lados proporcionados. Mantuvo además que diferencias en la forma cristalina implican diferencias en la composición química.
La estructura cristalina de un sólido iónico está determinada por dos factores:
- El tamaño relativo de los iones, que ocasiona la geometría de la estructura.
- La condición de que la estructura total sea eléctricamente neutra.
Los requisitos principales para la formación de compuestos iónicos son: energías de ionización relativamente bajas y afinidades electrónicas relativamente grandes, por lo que los compuestos típicamente iónicos son los formados por los elementos ubicados cerca de los extremos opuestos de la tabla periódica de los elementos.
En el dibujo se representa la estructura cristalina del NaCl. Cada ión Cl¯ esta rodeado por seis iones sodio, y cada ión sodio esta rodeado por seis iones cloruro, en cualquier cristal deNaCl se encuentran miles de millones de iones con esta distribución.
Según la notación de Lewis, la unión entre el Li y el F se representa
En los compuestos iónicos las intensas fuerzas coulómbicas son las directas responsables de la estabilidad lograda por el sistema. En estado sólido los iones interactúan electrostáticamente y se necesita bastante energía para separar esos iones. En estas condiciones los iones carecen de movilidad y no pueden conducir la corriente eléctrica. Cuando estos cristales se disuelven en agua la red se desarma y los iones quedan libres.
Otras características de los compuestos iónicos son:
- Puntos de Fusión y ebullición: la gran mayoría son sólidos a temperatura ambiente y tienen punto de fusión elevado.
- Solubilidad: en general, son solubles en agua y otros solventes polares.
- Dureza y fragilidad: Son duros y quebradizos, presentan resistencia al rayado.
Enlace Covalente
Como sabemos los átomos de los elementos adquieren similar estabilidad que los gases nobles si completan su capa externa. Una manera de hacerlo es compartir electrones con otros átomos que también necesitan alcanzar la estabilidad. En el enlace covalente las fuerzas que mantiene unidos los átomos son también de naturaleza electrostática, pero se producen cuando dos átomos comparten sus electrones.
Existen distintos tipos de enlaces covalente:
- Covalente común: este tipo de unión (A) establecida entre dos átomos en la cual el par electrónico está formado por un electrón de cada uno de los elementos. Este tipo de unión se establece entre átomos de un mismo elemento (enlace covalente no polar) o diferentes elementos (covalente polar).
Algunos elementos del Sistema Periódico tienen la particularidad de poder establecer uniones covalentes en las que entre dos átomos iguales se comparten más de un par de electrones formándose enlaces covalentes múltiples. Este es el caso, por ejemplo, de las moléculas de oxígeno (O2) y nitrógeno (N2).
- Enlace covalente polar
En este caso, los electrones no son atraídos de la misma manera por los núcleos y “pasarán más tiempo” cerca del núcleo del átomo más electronegativo. La diferencia de atracción de los núcleos genera un dipolo permanente sobre la molécula
Si consideramos la molécula de HCl, el Cl atrae al par de electrones del enlace con más fuerza que el hidrógeno, de forma que ambos electrones estarán más cerca del cloro, generándose así en la molécula una zona con un exceso de carga negativa (átomo de cloro) y otra con un defecto de carga negativa (átomo de hidrógeno).
El cloro no consigue arrancar del todo su electrón al hidrógeno, por lo que las cargas de ambos átomos son "parciales" y para designar este hecho se utilizan los símbolos δ- y δ+. El enlace covalente formado recibe el nombre de "enlace covalente polar". La molécula de HCl es una molécula polar porque en ella se aprecia una zona con mayor densidad de carga negativa separada de otra con defecto de carga negativa (dos polos).
Se puede considerar un enlace covalente polar como uno intermedio entre un enlace covalente puro (no polar) y un enlace iónico. En este sentido, se expresa a veces la polaridad del enlace como: Carácter iónico parcial.
Unión Metálica
En el caso que se unen átomos que tienen electronegatividad baja y cercana, ninguno de los átomos atraerá con gran fuerza los electrones de la unión. Los iones de una red metálica se disponen formando planos y los electrones de valencia se mueven libremente entre ellos. A pesar de estar formados por cargas del mismo signo, los planos no se repelen ya que la nube de electrones hace de pantalla, aunque pueden desplazarse unos sobre otros con facilidad. (ver figura). Este tipo de unión se denomina unión metálica y tiene como ejemplo principal los metales en su estado elemental.
Las propiedades de los metales de conducir la corriente eléctrica y el calor demuestran la libertad de los electrones para moverse en la red.
Los metales tienen punto de fusión y densidad elevadas, el conjunto de electrones unen fuertemente a los iones positivos.
La ductilidad y maleabilidad metálica se explican: los iones que tienen igual carga, se pueden deslizar fácilmente unos sobre otros en varias direcciones. El brillo metálico también se encuentra asociado a la movilidad de los electrones.
En la conducción electrónica que es el tipo de conducción que tiene lugar en los metales, la carga es transportada por los electrones. En la conducción ionica, la carga es transportada por los iones. Este es el mecanismo de conducción en una sal fundida o en solución electrónica. A causa de que los iones son demasiados voluminosos para viajar con facilidad a través de la mayoría de los sólidos, el flujo de carga a través de los sólidos es casi siempre un resultado de la conducción electrónica.
Resumiendo
Enlace Iónico
|
Enlace Covalente
|
Enlace Metálico
| |
Dureza
|
Duros y quebradizos
|
Sólidos blandos, líquidos o gaseosos
|
Amplia gama
|
Punto de fusión
|
Alto ( 600 a 3000°C )
|
Bajo ( -272 a 300°C)
|
Amplia gama ( -40 a 4000°C)
|
Conductividad
|
Aislante en sólido, pero conducto si está fundido o en disolución
|
Aislante o semiconductor
|
Conductor
|
Se forman entre
|
Metales y no metales
|
No metales y no metales
|
Metales
|
Ejemplos
|
KCl, Na2CO3
|
Cl2, CO2, H20, glucosa
|
Hierro, mercurio, cinc
|
FUERZAS INTERMOLECULARES
Las fuerzas de atracción intermoleculares se denominan fuerzas de Van der Waals y son fuerzas de atracción que existen entre las moléculas que son mucho más débiles que las interacciones covalentes entre los átomos de esa molécula. La energía que se requiere para separar moléculas es mucho menor que la energía para romper un enlace químico. Por eso se requiere menos energía para evaporar un líquido que para romper los enlaces de las moléculas de dicho líquido ya que la energía entregada en los cambios de estado es para vencer las fuerzas de interacción entre moléculas.
Como ejemplo, podemos mencionar que para romper el enlace H-Cl se requieren 431 kJ/mol. En cambio, para evaporar el HCL líquido solamente se requieren 16 kJ/mol
Para entender las propiedades de los distintos estados de la materia, necesitamos comprender y conocer los distintos tipos de fuerzas intermoleculares.Las fuerzas intermoleculares determinan algunas de las propiedades físicas de las sustancias, como su puntos de ebullición y de fusión.
Clasificación:Fuerzas de van der Waals
- dipolo – dipolo inducido o de London
- dipolo – dipolo
- Puente de Hidrógeno
Fuerza de London o de dipolos inducidos:
Surgen como resultado de dipolos temporales inducidos en átomos o moléculas por el corrimiento temporal de la nube de electrones.
Las fuerzas de dispersión se presentan en todas las sustancias moleculares, polares o no polares. Son el resultado de la atracción entre los extremos positivo y negativo de dipolos inducidos en moléculas adyacentes. Cuando los electrones de una molécula adquieren momentáneamente una distribución no uniforme, provocan que en una molécula vecina se forme momentáneamente un dipolo inducido.
La intensidad de estas fuerzas de dispersión depende de la facilidad con que se polarizan los electrones de una molécula, y eso depende del número de electrones en la molécula y de la fuerza con que los sujeta la atracción nuclear. En general, cuantos más electrones haya en una molécula más fácilmente podrá polarizarse. Así, las moléculas más grandes con muchos electrones son relativamente polarizables. En contraste, las moléculas más pequeñas son menos polarizables porque tienen menos electrones.
La importancia de las fuerzas de London aumenta con la mayor polarizabilidad de las moléculas, es decir la facilidad con la que la distribución del electrones en el átomo o molécula puede ser distorsionada y la misma, aumenta con el aumento de la masa molar.
Fuerza dipolo-dipolo:
Son fuerzas de interacción que existen entre moléculas polares (POLAR-POLAR). Una atracción dipolo-dipolo es una interacción no covalente entre dos moléculas polares o dos grupos polares de la misma molécula si ésta es grande. Estas moléculas forman dipolos permanentes si se enlazan átomos con electronegatividad diferente y la suma vectorial de los momentos dipolares de los enlaces es diferente a cero. Las moléculas que son dipolos se atraen entre sí cuando la región positiva de una está cerca de la región negativa de la otra.
Fuerza de interacción por puente de hidrogeno:
Es una fuerza de interacción entre un hidrogeno de una molécula polar unido directamente con un enlace covalente a O, N, F con un N, O o F de una molécula adyacente. Es un tipo especial de interacción dipolo-dipolo entre el átomo de hidrógeno que está formando un enlace polar, tal como N—H, O—H, ó F—H, y un átomo electronegativo como O, N ó F. El enlace de hidrógeno es de una de gran importancia cuando consideramos las propiedades de muchos compuestos, ya que es la explicación que se tienen para explicar las anomalías cuando comparamos los puntos de ebullición de algunas sustancias como ser el agua y el sulfuro de hidrógeno. Por peso molecular ( fuerzas de London ) el sulfuro de hidrógeno debiera presentar un pto. de ebullición mayor y por dipolo dipolo como el O es más electronegativo, debiera tener mayor temperatura el agua, pero eso sólo no explicaría la gran diferencia que existen entre esas dos moléculas. Esta interacción se representa de la forma siguiente:
NOMENCLATURA DE COMPUESTOS
- OXIDOS
Son compuestos químicos formados por la combinación de oxígeno ( actuando con número de oxidación -2 con cualquier otro elemento químico excepto F.
- Si se unen con un metal entonces tenemos los “óxidos básicos”, denominándolos como óxidos de ……..(metal) ( estado de oxidación del metal )
- Óxido de Hierro ( II ) FeO
- Óxido de Hierro ( III ) Fe2O3
- Si el elemento con el cual se combina es un no metal, entonces tendremos los óxidos ácidos.
Cl2O
|
Oxido hipocloroso
|
Oxido de Cloro ( I )
|
Cl2O3
|
Oxido cloroso
|
Oxido de Cloro ( III )
|
Cl2O5
|
Oxido clórico
|
Oxido de Cloro ( V )
|
Cl2O7
|
Oxido perclórico
|
Oxido de Cloro ( VII )
|
- Por convención se escribe el no metal o metal a la izquierda, y luego el Oxígeno, el cual siempre tiene un estado de oxidación -2, y por lo tanto el estado de oxidación del otro elemento debe ser positivo.
- HIDRUROS
Son compuestos formados por hidrógeno y metal. El Hidrógeno tendrá estado de oxidación -1 y el metal, siempre estado de oxidación positivo.
Se denominan como hidruros del metal ( estado de oxidación del metal ). Cu2H hidruro de cobre (II)
- HIDRACIDOS
Compuestos formados por un no metal e hidrógeno, teniendo este último estado de oxidación +1 y el no metal, número negativo. Se conocen no metal uro de hidrógeno. HCl cloruro de hidrógeno, pero la gran mayoría tienen nombres propios: agua, amoníaco, fosfina, metano, etc.
- HIDROXIDOS
Se forman al reaccionar un óxido básico con agua, denominándose hidróxido de metal ( estado de oxidación ) como KOH, hidróxido de potasio, Fe(OH)2 hidróxido de Hierro ( II ), etc.
- ACIDOS
Llamados también oxoácidos porque en su composición entran un óxido ácido y agua, y se llaman ácido del no metal con terminación oso ( menor estado de oxidación ) o ico ( mayor estado de oxidación como ser H2SO3 ácido sulfuroso y H2SO4 ácido sulfúrico.
EJERCICIOS
- Dadas las siguientes moléculas: CH4, Cl2, CO2, CH3OH; AlCl3,
- dibujar la estructura de Lewis de cada una de ellas.
- Alguna de ellas posee enlaces polares, de ser así cuáles átomos están involucrados en ese tipo de enlaces.
- ¿qué fuerzas intermoleculares estarán presentes entre moléculas de cada compuesto en estado líquido?
- Los puntos de ebullición de los haluros de hidrógeno son los siguientes:
- Justificar porque el HF tiene un pto de ebullición tan elevado, usando fuerzas intermoleculares
- ¿Qué tipo de interacciones moleculares se establecerán entre las moléculas de los otros haluros de hidrógeno y por qué su punto de ebullición aumenta a medida que descendemos en el grupo?
- Indicar que tipos de unión química tendrán los siguientes compuestos, indicando para cada uno de ellos, el diagrama de Lewis.
- BaCl
- HCl
- Na2O
- I2
- BF3
- Sean los siguientes compuestos
Compuesto
|
MgO
|
BaO
|
I2
|
Br2
|
HI
|
T° Fusión °C
|
2802
|
1923
|
114
|
-7
|
-51
|
Explicar, basándose en los tipos de enlace, las diferencias entre los puntos de fusión. Cuáles se disolverán mejor en agua.
- A medida que las fuerzas dipolo dipolo son más fuertes,
- El punto de fusión disminuye
- El punto de ebullición aumenta
- La molécula se hace menos polar.
- Ninguna de las anteriores es correcta.
- Nombrar los siguientes compuestos:
- Fe2(SO4)3
- KClO
- Al(NO3)3
- HBrO4
- Ag2O
- Na2SO3
- MgCO3
